MATERIAL:
1 agitador.
1 probeta de 100ml,
2 probetas de 10ml,
1 propipeta,
7 vasos de precipitado de 250ml,
1 piseta con agua,
1 gradilla,
10 tubos de ensayo,
1 circuito electronico,
2 placas de cobre,
1 par de caimanes,
disoluciones 0.1 M de pergamanato de potasio, acido clorihidrico, cloruro de sodio, hidroxido de sodio, hidroxido de amonio y acido acetico.
Procedimiento
experimento 1.
1.-rotular los vasos de precipitados de con los nombres de las disoluciones 0.1 M de pergamanato de potasio, acido clorihidrico, cloruro de sodio, hidroxido de sodio, hidroxido de amonio y acido acetico.
2.-agrega 10ml de disolucion en el vaso correspondiente
3.-un vaso solo contendra 10ml de agua destilada
4.-Registra en la tabla 1 los resultados observados en conductividad in dicando con la asignacion de:+ + + +
para la disolución que conduce más electricidad y asi sucesivamente hasta llegar ala solucion que condusca menos electricidad
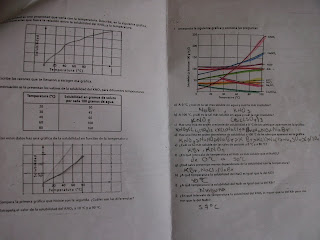
5.-Determina la cantidad de reactivo necesario en cada caso paea preparar 250ml de disolucion 0.1 M
Resultados
experimento 1
Reactivo fórmula Masa molar Gramos requeridos conductividad Acido clorhídrico HCl 36g/mol 0.9g Si
Hidróxido de sodio NaOH 40g/mol 1g Si
Hidroxido de amonio NH4OH 35g/mol 0.87g Si
Pregamanato de potasio KMnO4 100g/mol 2.5g Si
agua H2O 18g/mol 0.45g no
experimento 2
1.-rotular 10 tubos de ensayo del 1 al 10
2.-tomar 1ml la disolucion 0.1 M de pergamanato de potasio (KMnO4), colocala en el tubo de ensayo NO. 1 y agrega 9ml de agua. disuelvela por agiutació.
3.-Tomar 1ml del tubo NO.1 y colocarlo en el No.2 añadir 9ml de agua. agitalo.
4.-Repite el procedimineto hasta el tubo No. 10
5.-Dibuja los tubos de ensayo con las disoluciones registrando el color observado en la tabla 2.
tubo No. 1 2 3 4 5 6 7 8
color morado violeta violeta morado rosa transparente transparente transparente
concentración 1ml 1ml 1ml 1ml 1ml 1ml 1ml 1ml
conductividad si no no no no no no no
representación $ $ $ $ $ $ $ $
$ $ $ $ $ $ $
$ $ $ $ $ $
$ $ $ $ $
$ $ $ $
$ $ $
$ $
$